Sebanyak 100 ml larutan CH3COOH 0,2 m di campur dgn 100 ml larutan NAOH 0,2 m. Jika ka CH3COOH =1×10-⁵ maka pH larutan setelah di campur adalah

Mapel Kimia, Jenjang Sekolah Menengah Atas
jawabannya ada pada gamabr di atas
Pertanyaan Baru di Kimia
Pada saat besi dipanaskan didalam gas klor akan dihasilkan senyawa besi klorida yang mengandung 34,5% massa besi. A. Tentukan rumus empiris senyawa besi kloridab. Jika Mr senyawa = 325, bagaimana rumus molekul senyawanya .
Kimia, Sekolah Menengah Atas
Jawaban:
Rumus empiris: FeCl3
Rumus molekul: Fe2Cl6
Penjelasan:
Misal senyawa besi klorida = 100 gram
massa besi = 34,5% x 100 gram = 34,5 gram
massa klorida = 65,5℅ x 100 gram = 65,5 gram
Mencari perbandingan mol besi dengan klorida dengan rumus : mol = massa / Ar
Ar besi = 56 , Ar Cl = 35,5
mol besi = 34,5 / 56 = 0,62 mol
mol klorida = 65,5 / 35,5 = 1,84 mol
mol besi : mol klorida = 0,62 : 1,84 mol = 1 : 3
Jadi rumus empiris besi klorida: FeCl3
( FeCl3 ) n = Mr
( 1 x Ar Fe + 3 x Ar Cl ) n = 325
( 1 x 56 + 3 x 35,5 ) n = 325
( 111,5 ) n = 325
n = 2
( FeCl3 ) 2 => Fe2Cl6
Mohon pencerahan nya

Kimia, Sekolah Menengah Atas
Jawaban:
Menghitung Mr K2SO4
Mr K2SO4 = ( 2 x Ar K ) + ( 1 x Ar S ) + ( 4 x Ar O )
( 2 x 39 ) + ( 1 x 32 ) + ( 4 x 16 ) = 174
Menghitung mol K
massa K = n x Ar K
3,9 = n x 39
n = 0,1 mol
Menghitung mol K2SO4 dengan perbandingan koefisien:
Koefisien K : K2SO4 = 1 : 1 jadi mol K2SO4 = 0,1 mol
Menghitung massa K2SO4
massa K2SO4 = n x Mr
0,1 mol x 174 = 17,4 gram
Jawaban:
Berikut caranya ya
Semoga membantu 🙂
Hitunglah mol dari 1,8.10.²³ NaCL
Kimia, Sekolah Menengah Atas
Jawaban:
0,3 mol
Penjelasan:
Jumlah partikel = mol x 6×10^23
dimana 6×10^23 adalah tetapan bilangan Avogadro
berarti mol NaCl = 1,8×10^23 / 6×10^23 = 0,3 mol
Perbandingan massa besi dan massa oksigen pada senyawa besi (II) oksida adalah 7 : 2. Jika gas oksigen yang diperlukan adalah 14 gram. Maka massa besi yang bereaksi adalah …. Pilih salah satu:
a. 14 gram
b. 49 gram
c. 2 gram
d. 7 gram
e. 42 gram
Kimia, Sekolah Menengah Atas
Jawaban:
E.
Penjelasan:
Dengan perbandingan masaa Fe : O = 7 : 2 dan massa Oksigen yg diketahui adalah 14 gram, maka massa besi yg bereaksi = ( 7 / 2 ) x 14 gram = 49 gram
Kelompokkan struktur senyawa karbon berikut ke dalam senyawa karbon jenuh atau senyawa karbon tidak jenuh.
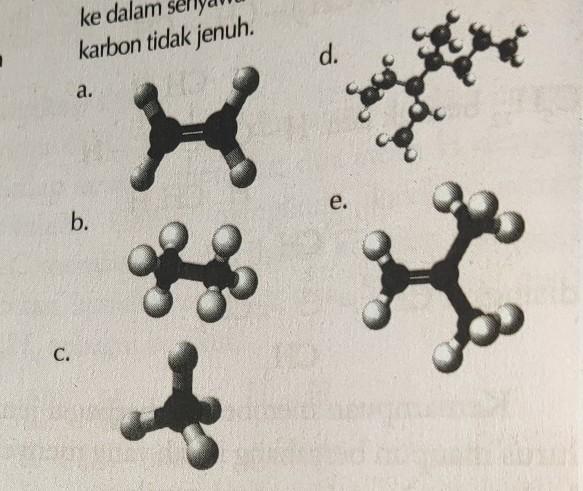
Kimia, Sekolah Menengah Atas
Penjelasan:
penentuan senyawa karbon jenuh dan tak jenuh ditentukan berdasarkan ikatan yang ada di dalam strukturnya. apabila hanya memiliki ikatan tunggal (alkana) maka disebut senyawa karbon jenuh. sedangkan apabila memiliki ikatan rangkap (alkena dan alkuna) maka disebut senyawa karbon tak jenuh.
pada gambar, senyawa a dan e memiliki ikatan rangkap sehingga disebut senyawa karbon tak jenuh
sedangkan b,c, dan d hanya memiliki ikatan tunggal maka disebut senyawa karbon jenuh
 Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya
Desain Grafis Indonesia Kumpulan Berita dan Informasi dari berbagai sumber yang terpercaya

